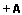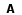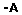Resumo: Neste trabalho foram sintetizados os derivados de 2-flúor, 2-cloro, 2-bromo e 2-iodo da cicloeptanona e ciclooctanona. Os procedimentos utilizados são todos conhecidos da literatura para compostos análogos e foram adaptados de acordo com as necessidades. Os compostos sintetizados foram purificados por destilação, com rendimentos razoáveis, exceto no caso dos fluor-derivados que foram purificados por HPLC. O estudo do equilíbrio conformacional das 2-halocicloeptanonas e 2-halociclooctanonas foi desenvolvido por meio de espectroscopia no infravermelho e cálculos teóricos. A analise no infravermelho foi realizada com as bandas observadas no estiramento fundamental e no primeiro overtone da carbonila em diferentes solventes, de modo a observar a influencia da polaridade do meio no equilíbrio conformacional destes compostos. As bandas foram devidamente deconvoluidas utilizando-se o programa GRAMS de forma a estabelecer a contribuição de cada conformero no equilíbrio. Os cálculos teóricos foram realizados com a teoria do funcional de densidade e métodos ab initio, considerando as moléculas tanto no vácuo quanto na presença de solventes, utilizando para isto modelos de solvatação contínuos. A preferência conformacional observada tanto pela espectroscopia no infravermelho quanto pelos cálculos teóricos se mostrou fortemente dependente da polaridade do meio, com os conformeros com maior momento de dipolo sendo favorecidos com o aumento da constante dielétrica do solvente. Alem disto, efeitos estereoeletronicos, tanto efeitos hiperconjugativos como efeitos estericos, influenciam na preferência conformacional. A análise através de cálculos com a teoria dos orbitais naturais de ligação (NBO) mostrou que a deslocalizacao eletrônica para o orbital π*C=O esta diretamente envolvido na maior estabilidade observada de determinadas conformações. O efeito devido ao halogênio substituído também pode ser notado, com alterações na preferência conformacional e na energia envolvida nas interações de NBO conforme o período do halogênio.
Abstract: In this work we synthesized the 2-fluor, 2-chloro, 2-bromo and 2-iodine derivatives of the cicloheptanone and cyclooctanone. The procedures used are all known from the literature for similar compounds and have been adapted according to the needs. The compounds were purified by distillation, with reasonable incomes, except in the case of 2-fluoro-derivatives, which were purified by HPLC. The study of the conformational equilibrium of 2-halocicloheptanonas and 2- halociclooctanonas was developed by means of infrared spectroscopy and theoretical calculations. The infrared analysis was performed with the bands observed in the fundamental carbonyl stretching and its first overtone in different solvents in order to observe the influence of polarity of the medium in the conformational equilibrium of these compounds. The bands were properly deconvoluted using the GRAMS program in order to establish the contribution of each conformer in equilibrium. Theoretical calculations were performed with density functional theory and ab initio methods, considering both the molecules in vacuum and in the presence of solvents, using a continuous solvation models for this. The conformational preference observed by both infrared spectroscopy and by theoretical calculations is strongly dependent with the polarity of the medium. The conformers with higher dipole moment is favored by increasing the dielectric constant of the solvent. Moreover, stereoelectronic effects, like hiperconjugative and steric effects, also influence the conformational preference. The analysis with the natural bond orbital theory (NBO) shows that the eletronic delocalization for the π*C=O orbital is directly involved in the observed stability of certain conformations. The effect of substituted halogen type can also be noticed, with changes in the conformational preference and energy involved in the interactions of NBO according the period of the halogen. |